© 2001. Sri Hastuti Posted 7 June 2001 (rudyct)
Makalah
Falsafah Sains (PPs 702)
Program
Pasca Sarjana / S3
Institut
Pertanian Bogor
Juni 2001
Dosen:
Prof Dr Ir
Rudy C Tarumingkeng (Penanggung Jawab)
Prof Dr Ir
Zahrial Coto
PENINGKATAN EFISIENSI PEMANFAATAN PAKAN MELALUI
SUPLEMENTASI
KROMIUM TRIVALENSI (Cr+3) PADA BUDIDAYA IKAN GURAME
(Osphronemus gouramy, Lac.) YANG RAMAH LINGKUNGAN
Oleh:
SRI HASTUTI
19600003/AIR
E-mail: subandiyono@hotmail.com
PENDAHULUAN
1. Latar Belakang
Ikan gurame (Osphronemus gouramy, Lacepede)
merupakan ikan asli Indonesia yang hidup pada habitat perairan air tawar. Kegiatan pemeliharaan secara sederhana di
pedesaan telah dilakukan sejak dahulu pada kolam tanah dengan memanfaatkan
berbagai jenis pakan yang tersedia secara alami di sekitarnya. Ikan ini mempunyai prospek yang sangat penting
dan potensial untuk dikembangkan. Selain
mempunyai tekstur daging yang kenyal dan enak rasanya, ikan gurame sering
disajikan pada berbagai kegiatan seremonial meskipun mencapai harga hingga tiga
kali lipat harga ikan mas. Namun, laju
pertumbuhan ikan gurame tergolong sangat lambat (Mokoginta dkk., 1995; Hasan
dkk, 2000; Jusadi dkk., 2000), meskipun dapat mencapai ukuran bobot individu 2
kg atau lebih bilamana dipelihara selama 5 tahun (Ardiwinata, 1981). Hal ini merupakan kendala utama yang dihadapi
hingga sekarang.
Berdasarkan pada kriterianya, budidaya ikan gurame masih
bersifat tradisional. Intensifikasi
belum memadai dikarenakan banyak hal.
Ketersediaan benih siap tebar belum mendukung, baik dari segi ketepatan
jumlah, kualitas, waktu maupun harga.
Kendala utama pada tingkat induk adalah fekunditasnya yang rendah. Seekor induk berumur 5 tahun hanya mampu
menghasilkan 3000 – 4000 butir (Saanin dalam Jhingran, 1975) atau bahkan
kurang. Pada tingkat larva, ikan
tersebut bersifat ‘fragile’ dan sangat rentan terhadap fluktuasi kualitas air
maupun selama transportasi yang berakibat pada tingginya mortalitas. Survival rate (SR) dari larva berumur 25
hingga 65 hari yang diberi pakan buatan berkadar protein 40% dengan nilai E/P
rasio 8 kkal/g protein masih belum mencapai 50% (yaitu hanya 25 – 40%),
meskipun dengan penambahan enzim eksogenous (Hasan dkk., 2000). Nilai SR dapat meningkat hingga 57.74% dengan
penurunan kandungan protein dan total energi pakan (yaitu menjadi 35% protein
dan total energi 2750 kkal/kg pakan atau dengan nilai E/P rasio 7.9 kkal/g
protein) (Arlia, 1994). Bahkan, dengan
penundaan pemberian pakan buatan hingga larva berumur 40 hari atau lebih dan
dengan penambahan berbagai level vitamin C (yaitu 115 – 345 mg L-ascorbyl-2-phosphate
magnesium per kg pakan) mampu meningkatkan nilai SR hingga 100% pada periode
pemeliharaan selama 8 minggu (Jusadi dkk., 2000). Perkembangan informasi tersebut sangat
penting namun konsistensi hasilnya perlu dikaji ulang guna mendapatkan paket
teknologi formulasi nutrisi yang standar bagi benih ikan gurame.
Pada beberapa
tahun terakhir ini, penelitian mengenai ikan gurame mulai difokuskan terhadap
aspek nutrisi, biologi maupun lingkungan hidupnya. Namun demikian, informasi yang komprehensif
guna menunjang keberhasilan budidaya yang efisien, ekonomis, mampu memenuhi
kebutuhan konsumen, dan berwawasan lingkungan masih terbatas. Penelitian secara intensif selama 4 tahun
pada aspek nutrisi telah dilakukan guna memperoleh informasi mengenai
dasar-dasar kebutuhan nutrisi yang tepat baik untuk pertumbuhan maupun
reproduksi ikan gurame (Mokoginta dkk., 1993; 1994; 1995; 1996), meskipun
kebutuhan nutrisi untuk berbagai stadia pembesaran belum sepenuhnya
diteliti.
Karena itu,
kendala utama yang masih dihadapi pada tingkat pembesaran adalah rendahnya
nilai laju pertumbuhan hingga ikan berukuran ‘plate size’ atau dengan bobot
tubuh 500 – 650 gram per ekor. Berbagai
usaha guna meningkatkan pertumbuhan telah dilakukan melalui perbaikan formulasi
pakan. Penelitian yang intensif tentang
kebutuhan protein, karbohidrat, dan total energi pakan telah dilakukan untuk
benih masing-masing dengan bobot tubuh berkisar antara 25 – 30 gram serta ±100
gram per ekor (Mokoginta dkk., 1993; Suprayudi dkk., 1994; Mokoginta dkk.,
1996). Diketahui bahwa kebutuhan protein,
karbohidrat, dan nilai E/P rasio optimal untuk masing-masing kelompok ukuran
adalah 32.14%, 41.98%, 8.0 kkal/g protein (total energi 257.12 kkal/100 g
pakan); dan 33.92%, 10.0 kkal/g protein (total energi 339.20 kkal/100 g pakan). Kebutuhan karbohidrat untuk ikan berukuran
±100 gram belum diketahui.
Berdasarkan pada informasi di atas maka terlihat bahwa
kebutuhan nutrisi (terutama protein) pada stadia pembesaran untuk mendukung
pertumbuhan yang optimal bagi ikan gurame masih relatif tinggi (yaitu berkisar
antara 32.0 – 34.0% protein). Dengan
demikian, potensi limbah organik bernitrogen yang dihasilkan adalah besar
terutama bila dikaitkan dengan periode pemeliharaan yang cukup lama. Bila dilihat dari kebutuhan total energi
pakan yang cenderung semakin meningkat dengan bertambahnya bobot tubuh (yaitu
dari 257.12 menjadi 339.20 kkal/100 g pakan), maka dapat diduga bahwa ikan yang
menuju ukuran ‘plate size’ membutuhkan energi yang semakin tinggi; dan hal
tersebut diharapkan dapat dipenuhi dengan kemampuannya dalam memanfaatkan
prosentase karbohidrat pakan yang lebih tinggi.
Peningkatan efisiensi pemanfaatan karbohidrat sebagai sumber energi
diharapkan dapat meningkatkan efisiensi protein untuk pertumbuhan, dan dengan
demikian berarti penurunan limbah organik bernitrogen.
Besarnya
limbah nitrogen yang terbuang dan masuk ke dalam lingkungan dapat dikalkulasi
secara matematis sebagai berikut.
Bilamana kandungan protein pakan yang diberikan adalah sebesar 32.0 –
34.0% maka nilai retensi protein 24.84 – 44.31% (asumsi rata-rata: 33.3%)
(Mokoginta dkk.,1996.). Hal ini berarti
bahwa setiap 1 ton protein yang diberikan maka hanya ±333 kg yang dapat diubah
menjadi protein daging ikan, dan selebihnya sebanyak ±666 kg terbuang sebagai
limbah nitrogen berupa partikel terlarut, mengendap di dasar kolam maupun
berbentuk gas (misalnya NH3).
Nilai ini akan lebih fantastik bilamana dihitung dalam bobot basah. Dengan asumsi bahwa kandungan protein dalam
tubuh ikan adalah sebesar 15.0 – 20.0%, maka apabila ingin diproduksi ±333 kg
protein asal ikan (atau ikan gurame dengan bobot 1665 – 2220 kg) diperlukan
1000 kg protein asal pakan (atau pakan dengan bobot kering 2941.2 – 3125.0
kg). Dengan demikian, pakan dengan bobot
kering sebanyak 712.2 – 1460 kg terbuang sebagai limbah. Dengan asumsi bahwa kandungan air dalam pakan
adalah 10% dan kemudian menjadi 80 – 85% dalam kolom air (sebagai bobot basah),
maka bobot pakan dapat membengkak menjadi 4.5 – 6.0 kali bobot kering (atau sebesar
3204.9 – 8760 kg) yang merupakan beban dalam air. Dengan demikian dapat diprediksi bahwa untuk
memproduksi ±333 kg protein asal ikan maka akan menghasilkan total limbah
setara dengan 3204.9 – 8760 kg bobot basah pakan.
Kromium trivalen (Cr+3) merupakan logam dari
kelompok trace-elemen yang bersifat esensial, baik untuk manusia, ruminansia
dan non-ruminansia termasuk ikan (McDowell, 1992; Mertz, 1993; NRC, 1997;
Hepher, 1988; Lukaski, 1999; Xi, 2001).
Dugaan pertama bahwa kromium berpartisipasi dalam metabolisme
karbohidrat pada hewan dilaporkan oleh Schwarz dan Mertz tahun 1957 (NRC,
1997). Kromium merupakan bagian atau
perlu untuk faktor toleransi glukosa (GTF), yaitu suatu komponen hati yang
larut dalam air, plasma darah, ragi brewer (‘brewer’s yeast’) dan beberapa
ekstrak biologis serta sel (Hepher,
1988). Dijelaskan bahwa kromium
trivalen, terutama dalam bentuk kompleks organik, berperan aktif dalam
metabolisme karbohidrat melalui ‘glucose tolerance factor’ (GTF) ) (Mertz,
1993). GTF merupakan kompleks Cr+3
dengan 2 bagian asam nikotinat dan 3 asam amino, terutama glisin, glutamat,
sistein atau sistin (Linder, 1992; NRC, 1997).
Kromium membentuk suatu kompleks dengan insulin dan reseptor insulin
untuk memfasilitasi respon dari jaringan yang sensitif pada insulin. Selanjutnya dijelaskan bahwa hewan yang
terganggu toleransi glukosenya terlihat defisien akan GTF, dan suplementasi
kromium meningkatkan toleransi glukosa (NRC, 1997). Toleransi glukosa juga diketahui meningkat
pada pemberian pakan dengan ragi bir (‘brewer’s yeast’) (Hepher, 1988).
Mertz et
al. (1974) dalam NRC (1997) mengusulkan suatu mekanisme yang mungkin
untuk kerja kromium yaitu bahwa kromium mengkatalisis pertukaran
(‘interchange’) sulfida antara insulin dan situs reseptor membran
sulfidril. Hal ini meningkatkan daya
ikat (‘binding’) dari insulin ke reseptor spesifik pada permukaan membran
plasma dari sel-sel jaringan target, dan dengan cara demikian berperan secara
sinergis meningkatkan potensi lintasan metabolik yang sensitif terhadap insulin. Dalam rangkumannya, Underwood (1971), Hepher
(1988), McDowell (1992) dan NRC (1997) menjelaskan bahwa elemen ini dapat
memperkuat potensi insulin dalam pengambilan glukosa, lipogenesis,
glikogenesis, dan transport serta pengambilan asam amino. Karena itu, diduga bahwa kromium mampu
meningkatkan efisiensi pemanfaatan karbohidrat dan protein pakan untuk
pertumbuhan.
Berbagai pengamatan yang telah dilakukan terhadap
pengaruh kromium dalam pakan ikan masih terbatas, meskipun perhatian yang lebih
dalam tahun-tahun terakhir telah difokuskan pada topik ini. Hertz et al. (1989) melaporkan bahwa
suplementasi kromium dari ransum berbasis tepung ikan dan tepung kedelai
meningkatkan penggunaan glukosa pada common carp (Cyprinus carpio). Peningkatan absorpsi intestinal dari glukosa
dilaporkan terjadi pada snakehead (Channa puctatus) pada konsentrasi
kromium yang rendah, yaitu 1mM (Sastry dan Sunita, 1982 dalam NRC,
1997).
Dilaporkan pula adanya pengaruh yang signifikan dari
kromium pakan terhadap pertumbuhan dan penggunaan karbohidrat oleh tilapia
hibrida (Oreochromis niloticus x O. Aureus). Hibrida tilapia diberi pakan ransum berbasis
tepung ikan yang mengandung baik tepung jagung atau glukosa 40% bobot basah
dengan atau tanpa suplementasi kromium (2 mg Cr/kg) sebagai CrCl3. Pakan tanpa suplementasi dianalisis
mengandung 0.4 mg Cr/kg. Perolehan bobot
dan retensi protein serta energi pada ikan yang diberi pakan mengandung tepung
jagung tidak dipengaruhi oleh suplementasi kromium namun jauh lebih besar bila
dibandinghan dengan ikan yang diberi pakan mengandung glukosa. Namun demikian, suplementasi kromium dari
pakan yang mengandung glukosa meningkatkan perolehan bobot, deposisi energi,
dan glikogen hati ikan secara signifikan, serta menunda puncak plasma glukosa
dari 2 ke 3 jam setelah makan. Dengan
demikian, suplementasi kromium meningkatkan penggunaan glukosa pakan, namun
bukan tepung jagung, oleh tilapia hibrida (Shiau dan Lin, 1993). Shiau dan Chen (1993) memberi pakan tilapia
hibrida dengan ransum berbasis tepung ikan seperti dijelaskan di atas,
mengandung tepung jagung atau glukosa dengan atau tanpa suplementasi kromium (2
mg Cr/kg) sebagai CrCl3, Na2CrO4.4H2O,
atau Cr2O3. Ikan
yang diberi pakan ransum tepung jagung, tanpa mempedulikan suplementasi atau
sumber kromium, mempunyai perolehan bobot, pengambilan pakan, retensi protein
dan energi, dan lipid tubuh yang jauh lebih besar dibandingkan dengan ikan yang
diberi pakan ransum dengan glukosa. Ikan
yang diberi pakan glukosa tanpa suplementasi kromium menunjukkan perolehan
bobot yang jauh lebih rendah dan juga waktu puncak glukosa plasma yang lebih
cepat serta peningkatan aktivitas glucose-6-phosphate, bila dibandingkan dengan
ikan yang diberi pakan ransum glukosa dengan suplementasi kromium, tanpa mempedulikan
sumbernya. Ikan yang diberi pakan ransum
glukosa dengan suplementasi Cr2O3
mempunyai perolehan bobot, pengambilan pakan, retensi protein dan energi, lipid
tubuh, dan aktivitas fosfofruktokinase mirip dengan ikan yang diberi pakan
ransum tepung jagung dan jauh lebih besar daripada yang ditemukan pada ikan
yang diberi pakan ransum glukosa lainnya.
Dengan demikian, suplementasi Cr2O3 pada pakan
yang mengandung glukosa meningkatkan penggunaan glukosa oleh tilapia hibrida
dan jauh lebih efektif daripada sumber-sumber kromium yang lain. Namun demikian, mekanisme spesifik bagaimana
kromium meningkatkan penggunaan glukosa pakan dalam tilapia hibrida tidaklah
dijelaskan.
Pada kajian selanjutnya, Shiau dan Liang (1995) mengamati
adanya peningkatan relatif perolehan bobot dan penggunaan pakan dari tilapia
hibrida yang diberi pakan suatu ransum yang mengandung tepung jagung terhadap
ikan yang diberi pakan suatu ransum yang mengandung glukosa. Ditemukan bahwa ikan yang diberi pakan ransum
yang mengandung glukosa dengan suplementasi Cr2O3 pada
konsentrasi 0.5% juga menunjukkan peningkatan perolehan bobot, efisiensi pakan,
perbandingan efisiensi protein, deposisi protein, dan aktifitas
fosfofruktokinase, dan juga kromium jaringan yang lebih rendah, daripada ikan
yang diberi pakan ransum yang mirip dengan suplementasi 2% Cr2O3. Pada Indian major carp (Labeo rohita)
juga telah dilaporkan adanya peningkatan pertumbuhan bilamana diberi pakan 10 mg
Cr/kg pakan, namun penurunan pertumbuhan terjadi bilamana diberi pakan 20 dan
40 mg Cr/kg; dan kromium karkas meningkat sejalan dengan intake kromium (Jain et
al., 1994).
Ruang lingkup dan batasan dari penelitian ini mencakup 3
komponen input yang meliputi pakan, hewan uji, dan air sebagai media
hidup. Pakan yang diteliti didasarkan
pada level dan jenis sumber karbohidrat, serta merupakan pakan semi-murni. Formula komponen nutrien yang dikembangkan
mengacu pada hasil penelitian Mokoginta dkk. (1993; 1994; 1995; 1996) untuk
stadia pembesaran, dengan penambahan ragi brewer. Kromium dalam bentuk CrCl3
diberikan pada berbagi tingkatan dan merupakan suplemen yang diharapkan
berperan dalam meningkatkan efisiensi pemanfaatan karbohidrat dan protein pakan
untuk pertumbuhan maksimum. Nilai energi
tercerna (‘digestible energy, DE’) untuk karbohidrat, protein dan lemak
masing-masing diasumsikan sebesar 2.5, 3.5, dan 8.1 kkal per gram (NRC, 1977). Hewan uji adalah ikan gurame stadia
pembesaran dengan bobot individu berkisar antara 60 – 80 gram. Ikan dipelihara dalam akuarium selama 6 bulan
setelah berlangsung periode aklimatisasi dan dengan metode pemberian pakan
hingga kenyang (at satiation).
Media pemeliharaan dipertahankan selalu berada pada kisaran yang optimal
dengan penerapan resirkulasi terkontrol.
Tujuan umum dari penelitian ini adalah diperolehnya informasi tentang ransum untuk pembesaran ikan gurame (Osphronemus gouramy, Lac.) dengan kriteria sebagai berikut: efisien, ekonomis, dan ramah lingkungan.
2. Perumusan Masalah
Pemanfaatan pakan oleh ikan gurame yang berukuran bobot
tubuh berkisar antara 60 – 80 gram tidak efisien. Hal ini dikarenakan 2 hal utama, yaitu: 1)
komposisi nutrien pakan yang diberikan tidak sesuai dengan keberadaan endoenzim
dalam saluran pencernaan, dan 2) jumlah energi yang disediakan dari karbohidrat
(yang berperan sebagai sumber energi) tidak memenuhi, sehingga sejumlah protein
digunakan.
Selama proses
pertumbuhannya, ikan gurame mengalami perubahan tingkah laku makan (‘feeding
habit’) yang sangat signifikan. Larva
ikan bersifat karnivora hingga ukuran atau umur tertentu, juvenil muda bersifat
omnivora, dan kemudian berubah menjadi herbivora hingga ukuran induk. Pola perubahan tersebut merupakan konsekuensi
dan terkait dengan pola perubahan enzimatik dalam saluran pencernaannya
(‘ontogenic development of the intestial endogenous enzym’).
Affandi dkk. (1994) mendeteksi
adanya aktivitas enzim lipase sejak larva belum mengambil pakan dari luar
dengan nilai unit yang tinggi namun perkembangan selanjutnya menurut umur
menjadi lebih lambat (peningkatan terjadi secara gradual). Aktivitas enzim protease terdeteksi sejak
awal perkembangan larva dengan nilai yang jauh lebih rendah dari lipase. Namun, perkembangan selanjutnya terjadi
sangat pesat melebihi aktivitas lipase.
Hasil yang serupa, yaitu adanya peningkatan aktifitas protease yang
signifikan dalam saluran pencernaan, juga dikemukakan oleh Arlia (1994) untuk
jenis ikan yang sama. Selanjutnya,
Affandi dkk. (1994) mengemukakan bahwa aktivitas enzim α-amilase pada awal
perkembangan larva justru hampir tidak terdeteksi, namun perkembangan
selanjutnya terjadi dengan sangat cepat melebihi aktivitas lipase dan bahkan
protease. Pengamatan pola perkembangan
endoenzim tersebut dilakukan sejak larva berukuran panjang tubuh ±0.7 cm (atau
berumur 10 hari) hingga berukuran 13.97 cm.
Berlainan dengan pola perkembangan α-amilase dan lipase yang terus
meningkat, protease terlihat mulai menurun setelah larva berumur ±53 hari
(Arlia, 1994). Pola perubahan endoenzim
dalam saluran pencernaan ikan membawa dampak terhadap pola kebutuhan
nutriennya. Nutrien sebagai substrat
akan dicerna dan dimanfaatkan dengan efisien dan maksimal bilamana sesuai
dengan ketersediaan enzim percernaannya.
Suplai yang tidak sesuai kemampuan daya cerna dari ikan
akan mengakibatkan pemanfaatan karbohidrat sebagai sumber energi tidak
maksimum, sehingga memungkinkan fungsi sebagian protein pakan berubah menjadi
sumber energi. Artinya, pemanfaatan
karbohidrat, dan konsekuensinya protein pakan untuk pertumbuhan, menjadi kurang
efisien. Keberadaan glukosa darah yang
tidak homeostatik atau mantap menjadi kendala bagi pemenuhan energi untuk
respirasi dan pertumbuhan.
Dampak
selanjutnya dari pemanfaatn protein yang kurang efisien ini adalah terbentuknya
limbah bahan organik bernitrogen yang terbuang dan masuk ke dalam lingkungan
atau media hidup dari ikan itu sendiri.
Feedback negatif kemungkinan besar terjadi karena proses dekomposisi
pada tahap tertentu dari limbah organik bernitrogen dapat menjadi gas-gas
toksik (misalnya NH3). Selama
penelitian, terjadi akumulasi gas-gas beracun sebagai hasil respirasi ikan
maupun dekomposisi anaerobik oleh bakteri.
Penuruan kandungan oksigen terlarut dan pH air juga terjadi. Agar sistem pemeliharaan berjalan dengan baik
maka kualitas air dipertahankan pada kisaran optimum.
Berdasarkan pada penjelasan di atas maka disusun diagram pendekatan masalah sebagaimana disajikan pada Gambar 1. Berdasarkan pada diagram tersebut, terlihat bahwa penelitian ini mencakup 2 sistem produksi dengan masing-masing fungsi produksinya sebagai berikut:
a. Fungsi produksi pada sistem I (pemanfaatan input pakan sesuai dengan perkembangan endoenzim pada saluran pencernaan ikan gurame 60 – 80 gram), yaitu:
Y = f (X1, T / X2, X3)
à X1 = f (X1.1, X1.2, X1.3)
à X2 = f (X2.1, X2.2, X2.2)
Y = f (X1.1/2.1, X1.2/2.2, T / X1.3/2.3, X2, X3)
Dimana: Y = output (produk: biomass, survivors)
X1 = input pakan; berpengaruh langsung terhadap Y
à X1.1 = karbohidrat; X1.2 = protein; X1.3 = lemak
T = periode waktu, perkembangan enzimatik saluran
pencernaan pada saat ikan berukuran 60-80 gram
X2 = input stok benih; faktor kondisional
à X2.1 = amilase; X2.2 = protease; X2.3 = lipase
X3 = input kualitas air; faktor kondisional
b. Fungsi produksi pada sistem II (pemanfaatan suplementasi Cr+3 ke dalam input pakan pada level karbohidrat tertentu untuk ikan gurame 60 – 80 gram), yaitu:
Y = f (X1 / X2, X3)
à X1 = f (X1.1, X1.2, . . . X1.n)
Y = f (X1.1, 1.2, . . . 1.n / X2, X3)
Dimana: Y = output (produk: biomass, survivors)
X1 = input pakan; berpengaruh langsung terhadap Y
à X1.1, 1.2, . . . 1.n = pakan dengan berbagai level Cr+3
X2 = input stok benih; faktor kondisional
X3 = input kualitas air; faktor kondisional
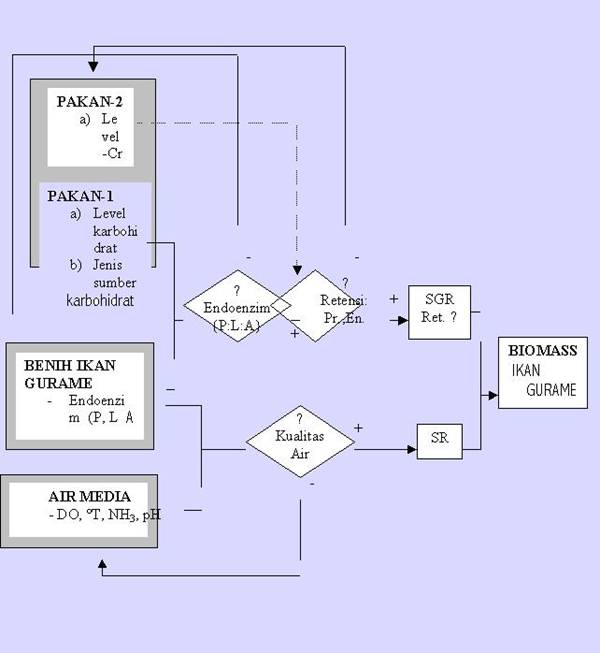
Gambar 1. Diagram pendekatan masalah peningkatan efisiensi pemanfaatan karbohidrat pakan melalui suplementasi Cr+3 pada budidaya ikan gurame
3. Hipotesis danTujuan
Hipotesis:
‘Apabila penggunaan suplemen Cr+3 mampu memantapkan keberadaan glukosa darah maka pemanfaatan karbohidrat sebagai energi menjadi lebih efisiensi sehingga retensi protein dan pertumbuhan menjadi meningkat’.
Tujuan Khusus:
1. Diketahuinya tingkat dan jenis sumber
karbohidrat yang tepat dalam pakan untuk pertumbuhan maksimum benih ikan gurame
ukuran 60-80 g.
2. Diketahuinya korelasi dari suplementasi
kromium dalam meningkatkan efisiensi pemanfaatan pakan melalui peningkatan
efisiensi pemanfaatan karbohidrat sebagai sumber energi.
Tujuan
Umum:
Optimalisasi dan efisiensi input pakan guna menghasilkan output pertumbuhan biomass maksimum dengan tetap memperhatikan kelestarian lingkungan (budidaya yang berwawasan lingkungan).
4. Hasil yang Diharapkan
Hasil yang diharapkan dicapai pada akhir penelitian adalah diperolehnya informasi tentang penggunaan suplementasi Cr+3 pada level tertentu yang mampu meningkatkan efisiensi pemanfaatan pakan melalui peningkatan efisiensi pemanfaatan karbohidrat sebagai energi sehingga meningkatkan retensi protein dan pertumbuhan untuk ikan gurame dengan bobot tubuh awal penebaran 60 – 80 gram.
II. METODOLOGI PENELITIAN
1. Tempat dan waktu penelitian
Penelitian
ini dilakukan di Laboratorium Nutrisi Ikan dan Laboratorium Lapangan, Jurusan Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan-IPB. Pembuatan pakan uji dan analisis proksimat
bahan pakan maupun pakan uji dilakukan di Laboratorium Nutrisi Ikan, Jurusan
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelauatn-IPB. Analisis asam amino dan asam lemak dilakukan
di Balitbio-Cimanggu, Bogor. Analisis
glukosa darah dilakukan di Laboratorium Penyakit Ikan, Jurusan Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelauatn-IPB. Analisis aktivitas enzimatik dan kandungan
kromium dilakukan di Laboratorium Teknologi Mikroba dan Biokimia, PAU-IPB,
Bogor dan/atau di Laboratorium Nutrisi Makanan Ternak, Fakultas
Peternakan-IPB.
2. Materi penelitian
a. Pakan uji
Pakan uji
yang dipergunakan berbentuk pellet dan merupakan pakan semi-murni. Jenis bahan penyusun pakan dan komposisi
nutrisinya merupakan modifikasi komposisi nutrisi untuk ikan gurame ukuran
sedang (yaitu 25 – 30 gram) dan besar (yaitu ±100 gram) menurut Mokoginta dkk.
(1993; 1994; 1994; 1996): kasein dan gelatin (sumber protein); α-strach
(standard untuk penentuan level karbohidrat pakan), pollard, terigu, bekatul
(jenis sumber karbohidrat pada penelitian tahap I); minyak jagung, minyak ikan
(sumber lemak); vit.-min. mix dengan penambahan vitamin C (sumber vitamin dan
mineral); ragi brewer (additif); alginat atau carboxymethil cellulose, CMC
(binder); dan BHT atau BHA (antioksidan).
Pakan dibuat isokalori. Sebagai
acuan, kandungan protein pakan berkisar antara 32 – 34% dengan nilai E/P ratio
±10 kkal/gram protein. Level karbohidrat
ditentukan berdasarkan uji pendahuluan pada tahap I, dengan level karbohidrat
sebagai acuan berkisar antara 39 – 42%.
Pakan
perlakuan yang terbaik pada tahap I dipergunakan sebagai acuan penyusunan pakan
uji tahap kedua dengan suplementasi Cr+3 (dalam bentuk CrCl3)
berkisar antara 0 – 100 ppm. Pakan
diberikan 3 kali sehari pada pagi, siang dan sore hari hingga ikan kenyang
(tidak bersisa dalam wadah). Jumlah
aktual pakan yang dikonsumsi dicatat guna penghitungan nilai efisiensi makanan,
retensi, dan variabel pertumbuhan lainnya.
b. Ikan uji
Ikan uji
adalah ikan gurame (Osphronemus gouramy, Lac.) dengan bobot tubuh
individu pada awal penebaran berkisar antara 60 – 80 gram. Tambahan ikan dengan kisaran bobot tubuh 80 –
100 gram juga diperlukan untuk uji aktivitas endoenzim. Selain sejumlah ikan uji yang terdapat pada
setiap perlakuan, diperlukan pula stok ikan yang dipelihara dengan pakan
perlakuan yang sama untuk pengukuran berbagai variabel penelitian lainnya. Ikan tersebut berasal dari petani di Kec.
Parung, Bogor.
c. Wadah pemeliharaan
Wadah uji yang digunakan adalah akuarium berdimensi (50x40x35) cm. Setiap wadah dilengkapi dengan sistem aerasi dan pemasukan serta pengeluaran air. Kontrol terhadap fluktuasi suhu air agar tetap berada pada kisaran optimum dilakukan dengan menggunakan heater. Semua wadah dirangkai menjadi satu sistem yang bersirkulasi dengan penggunaan sebuah bak filter yang terbuat dari fiber glass. Filter tersusun dari pasir dan kerikil sebagai komponen utamanya. Sebuah ‘submersible pump’ diperlukan guna mengangkat air yang sudah difilter untuk kemudian didistribusikan secara merata ke seluruh wadah perlakuan. ‘Flow rate’ dipertahankan sama untuk semua perlakuan. Sebelum dipergunakan, sistem pemeliharaan tersebut diaklimasikan terlebih dahulu selama ±4 minggu.
Selain akuarium, diperlukan pula happa polyethylene berdimensi (100x100x100) cm untuk pemeliharaan ikan stok dengan pemberian pakan yang sama sebagaimana perlakuan. Semua happa ditempatkan di dalam sebuah kolam tanah berdinding batu yang mempunyai luas 200 m2.
3. Metode penelitian
a. Tahap penelitian
Serangkaian penelitian ini dilakukan dalam dua tahap. Tahap I adalah penentuan level dan jenis sumber karbohidrat yang terbaik untuk pertumbuhan ikan gurame dengan bobot tubuh individu pada awal penebaran berkisar antara 60 – 80 gram. Pada tahap I dilakukan 3 penelitian yang meliputi: 1) penelitian aktivitas endoenzim saluran penceranaan (amilase, protease, lipase); 2) penelitian penentuan level karbohidrat pakan; 3) penelitian penentuan jenis sumber karbohidrat. Dua penelitian pertama merupakan penelitian pendahuluan untuk mendukung pelaksanaan penelitian utama (3).
Tahap II
merupakan penelitian lanjutan dari tahap I.
Hasil terbaik pada penelitian tahap I.3. dipergunakan sebagai
acuan. Pada penelitian tahap II ini
diterapkan berbagai level suplementasi kromium trivalen (Cr+3).
b. Variabel yang diukur dan cara
pengukurannya
Berbagai variabel yang diukur pada penelitian tahap I adalah: 1) laju pertumbuhan harian individu (α); 2) efisiensi makanan (e); 3) retensi protein (RP); 4) retensi lemak (RL); 5) retensi energi (RE); 6) aktivitas α-amilase; 7) aktivitas protease; dan 8) aktivitas lipase.
Pada tahap II, berbagai variabel yang diukur adalah: 1) laju pertumbuhan harian individu (α); 2) efisiensi makanan (e); 3) retensi protein (RP); 4) retensi lemak (RL); 5) retensi energi (RE); 6) daya cerna pakan; 7) pola homeostasi glukosa darah; dan 8) distribusi kromium pada jaringan otot, organ hati, dan serum.
Data penunjang adalah: 1) kandungan kromium, asam amino, dan asam lemak bahan dan pakan uji; 2) proksimat bahan dan pakan uji; 3) kelangsungan hidup (SR); 4) berbagai parameter kualitas air: DO, suhu, NH3, pH; dan 5) monitoring kondisi kesehatan ikan selama periode penelitian.
Cara
pengukuran variabel-variabel tersebut adalah sebagai berikut:
1. Laju pertumbuhan harian individu (α)
___ ___
Wt = Wo (1 + 0.01α)t (Huisman, 1976)
Dimana: α : Laju pertumbuhan harian individu (%)
___
Wt : Bobot rata-rata ikan pada waktu t (g)
___
Wo : Bobot rata-rata ikan pada awal penelitian (g)
t : Waktu selama dilakukan penelitian (hari)
Sampling
dilakukan secara periodik 2 kali setiap bulan.
Pengukuran dilakukan terhadap ikan yang dipelihara di dalam akuarium
maupun happa.
2. Efisiensi makanan (e)
Wt + D - Wo
e = __________ x 100 (NRC, 1977)
F
Dimana: e : Efisiensi makanan (%)
Wt : Bobot ikan pada akhir penelitian (g)
Wo : Bobot ikan pada awal penelitian (g)
D : Bobot total ikan yang mati selama penelitian (g)
F : Jumlah total makanan yang dikonsumsi (g)
3. Retensi protein (RP)
F - I
RP = ____ x 100 (Watanabe, 1988)
P
Dimana: RP : Retensi protein (%)
F : Bobot protein tubuh pada akhir penelitian (g)
I : Bobot protein tubuh pada awal penelitian (g)
P : Bobot protein yang dimakan ikan (g)
4. Retensi lemak (RL)
F - I
RL = ____ x 100 (Watanabe, 1988)
L
Dimana: RL : Retensi lemak (%)
F : Bobot lemak tubuh pada akhir penelitian (g)
I : Bobot lemak tubuh pada awal penelitian (g)
L : Bobot lemak yang dimakan ikan (g)
5. Retensi energi (RE)
F - I
RE = ____ x 100 (Tung dan Shiau, 1991)
P
Dimana: RE : Retensi energi (%)
F : Total energi tubuh pada akhir penelitian (g)
I : Total energi tubuh pada awal penelitian (g)
P : Total energi yang dimakan ikan (g)
6. Aktivitas α-amilase
Aktivitas α-amilase ditentukan dengan mengukur kemampuan enzim menghidrolisis larutan pati sehingga dibebaskan gula pereduksi (Affandi dkk., 1994). Jumlah gula pereduksi diukur dengan metode Shaffer Hartman dan Automatic Analysis Bochringer Mannheim-amylase PNP. Aktivitas amylase dinyatakan sebagai jumlah unit aktivitas enzim/menit/gram contoh. Sampel (yaitu saluran pencernaan) diambil dari 5 ekor ikan masing-masing dengan bobot tubuh individu ±60, ±70, ±80, ±90, dan ±100 gram (total 25 ekor).
7. Aktivitas protease
Aktivitas protease ditentukan dengan mengukur kemampuan enzim menghidrolisis protein sehingga dihasilkan tyrosin (Affandi dkk., 1994). Tyrosin yang dibebaskan diukur secara kolorimetrik. Prosedur analisis yang digunakan mengikuti prosedur yang digunakan oleh Fengxie (1988) dalam Wijayanti (1993). Aktivitas protease dinyatakan sebagai satuan unit aktivitas enzim/menit/gram contoh. Sampel (yaitu saluran pencernaan) diambil dari 5 ekor ikan masing-masing dengan bobot tubuh individu ±60, ±70, ±80, ±90, dan ±100 gram (total 25 ekor).
8. Aktivitas lipase
Aktivitas lipase diukur dengan menggunakan Polyexe-ethylene (Tween 20 atau ester laurat) sebagai substrat (Affandi dkk., 1994). Asam lemak yang dibebaskan membentuk garam asam lemak yang mengendap. Selanjutnya garam tersebut diukur secara turbidimetrik pada panjang gelombang 400 nm. Prosedur analisis mengikuti prosedur yang digunakan oleh Effendie (1992). Aktivitas lipase dinyatakan sebagai jumlah unit aktivitas enzim/menit/gram contoh. Sampel (yaitu saluran pencernaan) diambil dari 5 ekor ikan masing-masing dengan bobot tubuh individu ±60, ±70, ±80, ±90, dan ±100 gram (total 25 ekor).
 9. Daya cerna pakan
9. Daya cerna pakan
IP NF
D = 100 – 100 x ___ x ____
IF NP
Dimana: D : Daya cerna (%)
IP : Prosentase indikator dalam pakan (%)
IF : Prosentase indikator dalam pakan (%)
NF : Prosentase nutrien dalam feses (%)
NP : Prosentase nutrien dalam pakan (%)
10. Kadar glukosa darah
(Absorbansi sampel) x (konsentrasi standard)
Kadar glukosa plasma = ____________________________________
(mg/100 ml) Absorbansi standard
Konsentrasi glukosa diukur dengan spektrofotometer pada gelombang 635 nm. Sampling darah guna menentukan pola homeostasi glukosa darah dilakukan setiap jam selama 5 jam setelah pemberian pakan (‘postprandial’). Data tersebut diperoleh pada akhir penelitian untuk semua perlakuan. Darah ditampung dalam tabung venoject yang mengandung zat anti koagulasi darah (lithium-heparin).
11. Kandungan kromium
Pengukuran kandungan kromium dilakukan dengan menggunakan alat AAS (Shimadzu AA-680), dengan transmisi dari lampu ‘hollow cathode lamp L-233. Analisis kromium dilakukan pada jaringan otot, organ hati, plasma-serum, bahan panyusun pakan dan pakan uji.
12. Kandungan asam amino
Pengukuran asam amino dilakukan dengan liquid chromatography (LC) menurut DeLeenheer et al., (1992). Analisis kandungan asam amino dilakukan terhadap bahan panyusun pakan dan pakan uji.
13. Kandungan asam lemak
Pengukuran asam lemak dilakukan dengan Gas chromatography (GC) menurut DeLeenheer et al., (1992). Analisis kandungan asam lemak dilakukan terhadap bahan panyusun pakan dan pakan uji.
14. Analisis proksimat
Analisis proksimat dilakukan dengan mengikuti prosedur standard. Protein dianalisi dengan metode Kjeldahl, lipid dianalisis dengan metode ekstraksi ether menggunakan ekstraktor Soxhlet, sedangkan BETN dihitung berdasarkan komputasi setelah diketahui kandungan serat kasarnya (Watanabe, 1988). Analisis proksimat lengkap dilakukan terhadap ikan uji, bahan panyusun pakan dan pakan uji.
15. Kelangsungan hidup (SR)
Nt
SR = ___ x 100 (Effendie, 1979)
No
Dimana: SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah ikan yang hidup pada akhir penelitian (ekor)
No : Jumlah ikan pada awal penelitian (ekor)
16. Berbagai parameter kualitas air: DO, suhu, NH3, pH
Oksigen terlarut (DO) diukur dengan oksigen meter, pH dengan pH-meter, suhu dengan termometer min-max, dan NH3 dihitung berdasarkan pada hasil titrasi. DO, suhu, dan pH diukur setiap hari, sedangkan NH3 diukur seminggu sekali.
17. Monitoring kondisi kesehatan ikan
Monitoring kesehatan ikan dilakukan secara visual terhadap adanya luka atau lesi pada permukaan tubuh, hemorrhage pada pangkal ataupun bagian sirip, pola berenang, perubahan warna kulit, tingkat nafsu makan, dan gerakan operkulum.
c. Analisis data
Analisis keragaman (uji F) diterapkan pada tingkat
kepercayaan 95 dan 99%. Bila ternyata
dijumpai perbedaan diantara perlakuan maka dilakukan uji lanjut BNJ. Uji respon juga dilakukan terhadap data
tertentu, misalnya data respon pertumbuhan terhadap level karbohidrat maupun
suplementasi kromium dalam pakan.
DAFTAR PUSTAKA
Affandi, R., Mokoginta, I., Suprayudi, A.,
1994. Perkembangan enzim pencernaan ikan
gurame, Osphronemus gouramy, Lacepede.
J. Ilmu-Ilmu Perairan dan Perikanan Indonesia, 2(2): 63-71.
Ardiwinata, R.O., 1981. Pemeliharaan ikan gurame. Sumur Bandung, Bandung, 76 hal.
Arlia, A., 1994.
Pengaruh kaar protein pakan buatan terhadap pertumbuhan benih ikan
gurame (Osphronemus gouramy, Lacepede).
Tesis Program Pascasarjana-IPB, 126 hal.
DeLeenheer, A.P., Lambert, W.E., H.J. Nelis,
1992. Modern Chromatographic Analysis, 2nd
ed., Marcel Dekker, Inc., New York, USA.
Effendie, M.I., 1979. Metode biologi perikanan. Yayasan Dewi Sri, Bogor. 112 hal.
Effendie, R.. 1992. Pengaruh tingkat energi ransum terhadap
pertumbuhan pasca larva udang windu, Penaeus monodon, Fab. Tesis Program Pascasarjana IPB.
Hasan, O.D.S., Affandi, R., Mokoginta, I, Azwar,
N.R., 2000. Pengaruh pemberian enzim
papain dalam pakan buatan terhadap pemanfaatan protein dan pertumbuhan benih
ikan gurame (Osphronemus gouramy, Lac.).
J. Ilmu-Ilmu Perairan dan Perikanan, 7(1): 33-45.
Hepher, B., 1988.
Nutrition of pond fishes.
Cambridge Univ. Press, Cambrige, New York, USA. pp.: 217-252.
Hertz, Y., Mader, Z., Hepher, B., Gertler, A.,
1989. Glucose metabolism in the common
carp (Cyprinus carpio, L.): The effects of cobalt and chromium,
Aquaculture 76:255
Huisman, E.A., 1976. Food conversion efficiencies at maintenance
and production levels for carp (Cyprinus carpio L.), rainbow trout (Salmo
gairdneri, R.). Aquaculture, 9(3):
259-267.
Jain, K.K., Shinha, A., Srivastara, P.P.,
Berendra, D.K., 1994. Chromium: An
efficient growth enhancer in Indian
major carp, Labeo rohita. J.
Aquaculture Tropics, 9: 49
Jhingran, V.G., 1975. Fish and Fisheries of India. Hindustan Pub. Co. (India). Jawahar Wagan, Delhi 1007. 954 pp.
Jusadi, D., Muis, A., Mokoginta, I., 2000. Kebutuhan vitamin C benih ikan gurame (Osphronemus
gouramy, Lac.). J. Ilmu-Ilmu
Perairan dan Perikanan, 7(1): 17-25.
Linder, M.C., 1992. Nutrisi dan Metabolisme Karbohidrat. Dalam: Linder, M.C. (Ed.). Biokimia Nutrisi dan Metabolisme
(Terjemahan). UI-Press, Jakarta,
Indonesia, hal.: 261-344.
Lukaski, H.C., 1999. Chromium as suplement. Annu. Rev. Nutr., 19: 279-302.
McDowell, L.R.
1992. Minerals in animal and
human nutrition. Acad. Press, Inc., San
Diego, 524 pp.
Mertz, W., 1993.
Chromium in human nutrition: A review.
J. Nutr. 123: 626-633.
Mokoginta, I, Affandi, R., Suprayudi, M.A.,
Setiawati, M., 1993. Kebutuhan nutrisi
ikan gurame (Osphronemus gouramy, Lac) untuk pertumbuhan dan
reproduksi. Lap. Pen. HB. II/1,
Dirbinlitabmas, Dikti, Depdikbud.
IPB.
Mokoginta, I, Affandi, R., Suprayudi, M.A.,
Setiawati, M., 1997. Kebutuhan nutrisi
ikan gurame (Osphronemus gouramy, Lac) untuk pertumbuhan dan
reproduksi. Rangkuman Pen. HB. II/1-4,
Dirbinlitabmas, Dikti, Depdikbud.
IPB.
Mokoginta, I, Suprayudi, M.A., Setiawati, M.,
1994. Kebutuhan nutrisi ikan gurame (Osphronemus
gouramy, Lac) untuk pertumbuhan dan reproduksi. Lap. Pen. HB. II/2, Dirbinlitabmas, Dikti,
Depdikbud. IPB.
Mokoginta, I, Suprayudi, M.A., Setiawati, M.,
1995. Kebutuhan nutrisi ikan gurame (Osphronemus
gouramy, Lac) untuk pertumbuhan dan reproduksi. Lap. Pen. HB. II/3, Dirbinlitabmas, Dikti,
Depdikbud. IPB.
Mokoginta, I, Suprayudi, M.A., Setiawati, M., 1996. Kebutuhan nutrisi ikan gurame (Osphronemus
gouramy, Lac) untuk pertumbuhan dan reproduksi. Lap. Pen. HB. II/4, Dirbinlitabmas, Dikti,
Depdikbud. IPB.
Mokoginta, I, Suprayudi, M.A., Setiawati, M.,
1995. Kebutuhan optimum protein dan
energi pakan benih ikan gurame (Osphronemus gouramy, Lac.). J. Pen. Perikanan Indonesia, 1(3):
82-94.
NRC, 1977.
Nutrient requirement of warmwater fishes. National Acad. Press, Washington, D.C., USA
17 pp.
NRC, 1997.
The role of chromium in animal nutrition. National Acad. Press, Washington, D.C., USA,
80 pp.
Shiau, S.Y., Chen, M.J., 1993. Carbohydrate utilization by tilapia (Oreochromis
niloticus x O. aureus) as influenced by different chromiun sources. J. Nutr. 123: 1747-1753.
Shiau, S.Y., Liang, H.S., 1995. Carbohydrate utilization and digestibility by
tilapia, Oreochromis niloticus x O. aureus, are effected by chromiun
oxide inclusion in the diet. J. Nutr.
125: 976-982.
Shiau, S.Y.,
Lin, S.F., 1993. Effects of
supplemental dietary chromium and vanadium on the utilization of different
carbohydrate in tilapia (Oreochromis niloticus x O. aureus). Aquaculture, 110(3-4): 321-330.
Suprayudi, M.A., Setiawati, M., Mokoginta, I.,
1994. Pengaruh rasio protein energi yang
berbeda terhadap pertumbuhan ikan gurame (Osphronemus gouramy,
Lac.). DP3M. DIKTI.
DEPDIKBUD. Institut Pertanian
Bogor. 67 hal.
Tung, P.H., Shiau, S.Y., 1991. Effect of meal frequency on growth
performance of hybrid tilapia, Oreochromis noloticus x O. aureus, fed different
carbohydrate diets. Aquaculture, 92:
343-350.
Watanabe, T., 1988. Fish nutrition and mariculture. JICA, Tokyo Univ. of Fisheries, 233 pp.
Wijayanti, D., 1993. Studi aktivitas protease pada benih ikan
gurame (Osphronemus gouramy, Lac) dengan perbedaan saat awal pemberian
pakan buatan. Skripsi Program Studi
Manajemen Sumberdaya Perairan, Fak. Perikanan-IPB.
Xi, G., Xu, Z., Wu, S., Chen, S., 2001. Effect of chromium picolinate on growth performance,
carcass characteristics, serum metabolites and metabolism of lipid in
pigs. Asian-Australian Journal of Animal
Sciences. 14(2): 155-296.